Protocolo de atención frente a un accidente con punzocortantes
FÍSTULA NASOALVEOLAR
Introducción
En la década de 1950, el cierre de fístula nasoalveolar (FNA) que se realiza en edades tempranas, (injerto primario) demostró una serie de complicaciones, sobre todo alteraciones en el crecimiento y fracaso en la erupción dental.1 En 1961 se informa por primera vez en la literatura inglesa el cierre de fístula nasoalveolar descrita por Boyne y Sands, quienes demostraron que el desarrollo del maxilar podría favorecerse si se realizan injertos en etapas adecuadas.1,4 Así, se determinó que el 85% del crecimiento del tercio medio se ha completado después de la erupción de los primeros molares permanentes, tiempo ideal para la colocación de injertos nasoalveolres.1,2,4 Colocación de injertos y cierre de la fístula De este modo, se describen cuatro etapas ideales para la colocación de injertos y cierre de fístula nasoalveolar: 1. Injerto óseo primario. Se realiza durante los primeros meses de vida y consiste en la colocación del injerto en el sitio de la hendidura. En la actualidad si se utiliza deberá combinarse con ortopedia maxilar.1,5 2. Injerto óseo secundario temprano. Este injerto se realiza antes de la erupción de los órganos dentarios permanentes entre los 5 y 8 años. La principal ventaja es que produce una guía ósea para la erupción del incisivo lateral si es que está presente y del canino con la finalidad de proveer mejor soporte óseo y salud periodontal.3,6 3. Injerto óseo secundario. Este injerto se realiza en la dentición mixta, entre los 8 y 12 años en conjunto con ortodoncia para aproximar los segmentos maxilares antes de la cirugía

Lo ideal es realizar el injerto cuando el desarrollo radicular del canino se encuentra en ½ o en ¾ del total. El injerto secundario es el más utilizado, ya que es predecible en el tiempo y seguro en sus resultados. La mayor ventaja es permitir la erupción del canino a través del injerto, mejorando su estabilidad y salud periodontal. Este tipo de injerto ha demostrado tener menor repercusión en el crecimiento; sin embargo, dentro de sus desventajas se encuentra la reabsorción ósea.2,6,7 4. Injerto secundario tardío. Este injerto se realiza cuando ya han erupcionado los órganos dentarios, por lo que no tiene éxito si se desea la erupción de algún diente. Es utilizado únicamente para darle continuidad al reborde alveolar y favorecer a la rehabilitación posterior con un implante dental.2,6,7 Así como existen diferentes tipos de técnicas para el cierre de las FNA, se disponen de variedad de injertos, que de acuerdo con la edad del paciente serán complemento en el tratamiento.8 Los injertos se clasifican en: • Aloinjerto: compuestos de tejidos tomados de un individuo de la misma especie, pero genéticamente diferente. • Xenoinjerto: compuestos de tejidos to mados de un donador de otra especie. • Autoinjerto: compuestos por tejidos tomados del mismo individuo. • Aloplásticos: (sintéticos y/o naturles) como la hidroxiapatita.8,9 El autoinjerto normalmente se obtiene de la cresta iliaca y su uso es frecuente; sin embargo, se han asociado limitantes tales como mayor morbilidad del sitio donador, alto costo y recuperación lenta.9 La matriz ósea desmineralizada (MOD) se obtiene de aloinjerto y ha sustituido el uso del injerto de cresta iliaca, ya que posee propiedades osteoinductoras y osteoconductoras para generar nuevo hueso de calidad, sin la necesidad de someter al paciente a una cirugía bajo anestesia general.10, 11 Aspirado medular El aspirado medular utilizado en ortopedia como tratamiento de no uniones ha demostrado ser eficaz y seguro, permitiendo la cicatrización ósea más predecible con menor morbilidad.12 Actualmente es una opción en cirugía maxilofacial y se utiliza acompañado de otro tipo de injerto para mejorar las propiedades osteogénicas. De esta manera, se combinan los elementos necesarios y se integra la triada que consiste en tener una matriz osteoconductora, moléculas de señalización

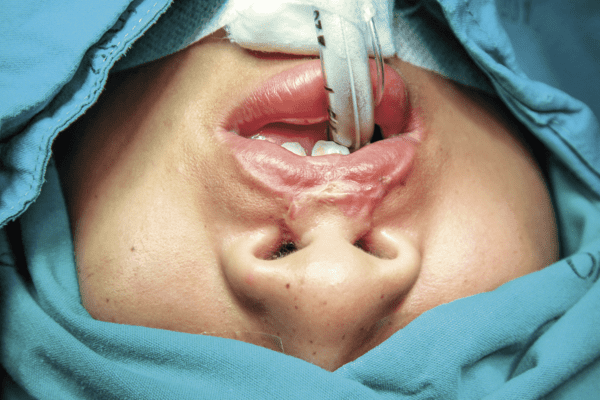
BMP, PDGF) y las células (osteoblastos, fibroblastos) que nos aseguraran obtener hueso de calidad.13 La presencia de células mesenquimatosas y osteoprogenitoras se ha documentado a través de estudios de inmunohistoquímica donde marcadores especializados como CD90, CD44, y CD105 confirman su presencia en el aspirado medular.14,15 Además de sus características principales que favorecen la regeneración ósea, el aspirado medular es un método no invasivo, económico que se puede realizar bajo anestesia local.12,14 Son pocas las complicaciones que se han informado, como rotura del trocar y contaminación. Por lo demás, se reporta como una técnica segura, eficaz y de bajo costo.14 Presentación de caso clínico Paciente femenino de 16 años de edad, originaria de la Ciudad de México, con antecedentes heredofamiliares de hipertensión arterial por parte de abuela paterna, resto sin importancia para el padecimiento actual; antecedentes personales patológicos, labio y proceso alveolar hendido izquierdo, labioplastia a los 12 meses. Como secuela presenta fístula nasoalveolar izquierda. Previo protocolo quirúrgico se realiza el cierre de fístula nasoalveolar con injerto alogénico, aloplástico y aspirado medular. Se realiza injerto óseo secundario tardío para darle continuidad al reborde alveolar y posteriormente rehabilitación protésica con la colocación de un implante dental. Bajo los estándares de asepsia y antisepsia se realiza aspirado medular de cresta iliaca derecha y se infiltran 2 cc de lidocaína al 2% con epinefrina 1:100,000. Localizando la cresta iliaca y espina iliaca anterior derecha se introduce el trocar 2 cm detrás de la cresta iliaca anterior, con una profundidad no mayor a 10 mm. A continuación, se retira la lanceta y se comienza el aspirado con una jeringa de 20 cc, aspirando 2 cc de medula ósea (fig. 1), la cual es mezclada con 1 g de injerto alogénico Putty de Grafton® + hidroxiapatita (fig. 2). Se corrobora hemostasia y se coloca protector de piel. En el mismo tiempo quirúrgico se prepara el lecho receptor de injerto con técnica Philiph Boyne bajo anestesia local y se coloca el injerto previamente embebido en aspirado medular. Se sutura por planos con Vicryl 4-0.


Se toma una radiografía oclusal a los 4 meses de posoperatorio, observando la formación de un puente óseo que se visualiza como una imagen radiopaca en el sitio de la hendidura (fig. 3). Discusión Para realizar el cierre de FNA se han propuesto diversas técnicas, materiales e injertos, dentro de los cuales el estándar de oro es el injerto autólogo de cresta iliaca, ya que favorece la osteogénesis, osteoinducción y osteointegración. Sin embargo, se conocen complicaciones que se pueden presentar, como fracturas, hemorragia, parestesias, requerimiento de hospitalización y recuperación lenta.17 Los materiales aloplásticos y aloinjertos en la actualidad no han tenido el éxito esperado que se obtiene con el injerto autólogo; sin embargo, en combinación mejoran su capacidad para la producción de hueso nuevo.1,4,18,19 El aspirado medular ofrece ventajas que destacan considerablemente al mejorar la capacidad osteoinductora y osteoconductora de los injertos alogénicos y aloplásticos, promoviendo a través de las células mesenquimatosas y osteoprogenitoras la formación de nuevo hueso (osteogénesis).13,14,21 Conclusiones El cierre de fístulas nasoalveolares deberá llevarse a cabo en la edad indicada para favorecer la erupción dental y los objetivos específicos del tratamiento.1,22 .Cuando se desea dar continuidad al reborde alveolar y permitir posteriormente la colocación de un implante dental, el cierre de fístula nasoalveolar secundario tardío es el más indicado. El aspirado medular de cresta iliaca posee células osteoprogenitoras y mesenquimatosas que al combinarse con otros injertos mejoran la capacidad para producir nuevo hueso. Estas células se han informado en estudios de inmunohistoquímica a través de los marcadores CD90, CD44, y CD105.13,14,23 La técnica de aspirado medular contiene células osteprogenitoras que promueven la regeneración ósea y se caracteriza por ser no invasiva, económica y realizarse bajo anestesia local.12,14 Al utilizar matriz ósea desmineralizada proveniente del injerto alogénico, aspirado medular y un injerto aloplástico como la hidroxiapatita, se asegura la formación de hueso de calidad a través de la osteoinducción, osteoconducción y osteogénesis.13

ReferenciasRicalde P, Savastano N. Management of the cleft maxilla En: Fonseca R, Marciani, Turvey, Oral and Maxillofacial Surgery. 2da. edición. Missouri: Elsevier, 2009; 806-812. Wyszynski DF. Cleft lips and palate. Role of the orthodontist in the management of patients with cleft lip and/or palate. Honk Kong: Oxford University, 2002; 381-395. Hall HD, Werther JR. Management of Cleft Lip and Palate Conventional Alveolar Cleft Bone Grafting, Oral and Maxillofacial Surgery Clinics of North America. 1991;3(3). Posnick JC. Cleft Lip and Palate: Bone grafting and management of residual oronasal fistula En: Posnick Jeffrey C et al., Craneofacial and Maxillofacial surgery in children and Young adults.. Philadelphia 2000: 827-859. Miloro M, Ghali G, Larsen P, Waite P. Peterson’s Principles of Oral and Maxillofacial Surgery, Capítulo Reconstruction of the alveolar cleft. 2da edición. 2004; 839-858.4. Nelson CL. Oral and Maxillofacial Surgery Management of Cleft Lip and Palate: Primary Alveolar Cleft Bone Grafting. Clinics of North America 1991;3(3). Uribe FF, Castellón ZL, Laissle CG. Erupción del canino permanente a través de injertos óseos alveolares secundarios en pacientes con fisuras labiopalatinas. Revista odontológica mexicana 2007;11(4):207-214 Boyne PJ, Sands NR. Secondary Bone Grafting of Residual Alveolar and Palatal Clefts. J Oral Surg 1972;30:87-93. Boyne PJ. Management of Cleft Lip and Palate. Bone Grafting in the Osseous Reconstruction of Alveolar and Palatal Clefts, Oral and Maxillofacial Surgery Clinics of North America 1991;3(3). Robert M, Stern D. Philosophy and particulars of autogenous bone grafting. Oral and Maxillofacial Surgery Clinics of North America Honk Kong 1993(5)4.. Lindsey RW, Wood GW, Sadasivian KK, Stubbs HA, Block JE. Grafting long bone fractures with demineralized bone matrix putty enriched with bone marrow: pilot findings. Ortophedics 2006; 29(10):939-41.. Callan DP, Salkeld SL, Scarborough N. Histologic analysis of implant sites after grafting with demineralized bone matrix putty and sheets. Implant Dent 2000.9(1):36-44. Hernigou P, Poingard A, Beaujean F, Rouhard H. Percutaneous Autologous Bone-Marrow Grafting for Non-unions. Influence of the number and concentration of progenitor cells. Journal of Bone and Joint Surgery 2005;87(7):1430-1437. Lynch E, Marx R, Myron N, Wisner L. Tissue Engineering, applications in Oral and Maxillofacial Surgery and Periodontics, Segunda edición. China: Quintessence books, 2008. Marx R, Stevens MR. Atlas of oral and extraoral bone harvesting. Canadá: Quintessence, 2010;141-149 Hirata TM, Ishkitiev N, Yaeqaki K, Calenic B Ishikawa H, Nakahara T, et al. Expression of Multiple Stem Cell Markers in Dental Pulp Cells Cultured in Serum-free. J Endod 2010; 36(7):1139-44. Kasten P, Luginbúhl R, Griensven M, Barkhausen T, Krettek C, Bohner M, Bosch U. Comparison of human bone marrow stromal cells seeded on calcium-deficient hydroxyapatite, B-tricalcium phosphate and demineralized bone matrix. Biomaterials 2003; 24(15); 2593-2603. Kalk WW; Raqhoebar G, Jansma J, Boering G. Morbidity from Iliac Crest Bone Harvesting. J Oral Maxillofac Surg 1996, 54(12):1424-1429. Wolford L et al. Management of Cleft Lip and Palate. Utilization of alloplastic cremics in repair of alveolar clefts and correction of skeletofacial deformities in patients with cleft palate. Oral and Maxillofacial Surgery Clinics of North America 1991;3(3). Fonseca RJ et al. Management of Cleft Lip and Palate. Allogenic Grafting of dentoalveolar clefts. Oral and Maxillofacial Surgery Clinics of North America 1991;(3):3. Feichtinger M, Mossböck R, Kärcher. Evaluation of bone volume following bone grafting in patients with unilateral clefts of lip, alveolus and palate using a CT-guided three-dimensional navigation system. Journal of Cranio-Maxillofacial Surgery 2006;34:144-149. Takahashi Y, Yamamoto M, Tabata Y. Osteogenic differentiation of mesenchymal stem cells in biodegradable sponges composed of gelatin and b-tricalcium phosphate. Biomaterials 2005; 26:3587-3596. Epker BN. Alveolar anterior maxillary cleft repair. Atlas Oral Maxillofacial Surgery. Clinics North America 2009:17:167-173. Van Damme P. The vistas and horizons of bony reconstruction-Commentary. Journal of Cranio-maxillofacial Surgery 2005;33:75-78.